丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂婱嬥懏偺幚尡
丂丂婱嬥懏偲偼丄嶻弌検偑彮側偔丄揱摑揑丒彜嬈揑偵壙抣偺偁傞乭婱廳側乭嬥懏丄偺傎偐偵丄晠怘偣偢奜娤偑曄傢傞偙偲偑側偄偲偄偭偨傛偆側丄壔妛揑偵乭婱側乭嬥懏丄偲偄偆堄枴崌偄傕偁傞丅
丂丂丒丂乮梊旛幚尡乯丂嬥丄敀嬥丄儘僕僂儉梟塼偺儅僌僱僔僂儉偵傛傞愅弌丗丂嬥乮俙倳乯丄敀嬥乮俹倲乯丄儘僕僂儉乮俼倛乯偺侾侽侽侽倫倫倣乮嬥懏偲偟偰 侽丏侾亾乯墫壔暔梟塼偵丄壔妛揑偵乭斱乭側儅僌僱僔僂儉乮儕儃儞忬乯傪擖傟傞偲丄偦傟偧傟偺嬥懏偑抲姺乮僙儊儞僥乕僔儑儞乯偟偰愅弌偡傞丅乮侾侽倣倢偱侾侽倣倗傎偳丄仏 儘僕僂儉偼傕偆彮偟擹搙偑崅偄偲丄偒傟偄側僶儔怓偵側傞丅乮俼倛倧倓倝倳倣偼僶儔丗倰倧倱倕偐傜偺柦柤乯乯
丂丂嬥偼梈揰偑侾侽俇係丏俀亷偱丄僈僗僶乕僫乕乮侾係侽侽亷乯偱壛擬偡傞偲梟梈偡傞丅敀嬥丄儘僕僂儉偼梈揰偑崅偄乮俹倲丗侾俈俇俉丏俁亷丄俼倛丗侾俋俇係亷乯偺偱巁慺傾僙僠儗儞僶乕僫乕乮俁侽侽侽亷乯偱側偄偲梟梈偟側偄丅

丂丂乮侾乯丂嬧偺幚尡丗
丂丂嬧乮尨巕斣崋 係俈丄尨巕検 107.87丄斾廳 侾侽丏係俋丄梈揰 俋俇侾丏俉亷丄暒揰 俀侾俇俀亷丄寢徎峔憿 俥俠俠乮柺怱棫曽乯丄僋儔乕僋悢 0.00001亾乯偼丄壛岺偟傗偡偔丄婱嬥懏偺拞偱傕壙奿偑埨偔丄壔妛揑偵傕乭斱乭側曽側偺偱斾妑揑埖偄傗偡偄嬥懏偱偁傞丅丂嬧偺摫揹棪乮俇俁亊106 m-1丒兌-1乯丄擬揱摫棪乮係俀俋 W丒m-1丒K-1乯丄壜帇岝偺斀幩棪乮俋俉亾乯偼偄偢傟傕嬥懏拞嵟戝偱偁傝丄揥惈丄墑惈偼嬥偵師偖丅乮侾倗偺嬧偼堷偒敳偒壛岺偱栺俀俀侽侽倣偺慄偵墑偽偡偙偲偑偱偒傞乯
丂丂嬧偼墫巁傗棸巁偵偼丄悈慺傛傝傕僀僆儞壔孹岦偑彫偝偔丄墫壔嬧丄棸巁嬧偲偄偆悈偵晄梟惈偺枌傪惗偠偰梟夝偟側偄偑丄巁壔惈偺巁偱偁傞徤巁偵偼 婓徤巁丄擹徤巁嫟偵傛偔梟夝偟偰徤巁嬧乮俙倗俶俷3乯傪惗偠傞丅乮婓徤巁偱偼俶俷丄擹徤巁偱偼俶俷2傪敪惗乯
丂丂徤巁嬧偺悈梟塼偼丄僔傾儞僀僆儞傗僠僆棸巁僀僆儞偵偼偦傟偧傟偺壔崌暔偺捑揳偑弌棃傞偑丄夁忚偵壛偊傞偲偦傟偧傟偺嶖僀僆儞偑宍惉偝傟梟夝偡傞丅僔傾儞壔嬧乮俙倗俠俶乯偼嬧儊僢僉偵梡偄傜傟傞丅丂嬧偼嬻婥拞偱埨掕偱偼偁傞偑丄棸墿壔崌暔乮棸壔悈慺側偳乯偵偼斀墳偟偰昞柺偑崟偔側傞寚揰乮俙倗2俽偺惗惉乯偑偁傞偺偱丄嬧婍傗嬧傔偭偒惢昳偺忋偵丄敄偔僷儔僕僂儉傗儘僕僂儉傔偭偒偑巤偝傟偙偺揰偑夵慞偝傟偰偄傞丅丂傑偨徤巁嬧偼傾儞儌僯傾悈偲彊乆偵斀墳偟偰 棆嬧乮俙倗3俶乯偲偄偆崟怓偺敋敪惈暔幙偑偱偒傞偺偱拲堄傪梫偡傞丅
丂丂嬧偺梡搑偼丄曮忺昳傗怘婍丄壿暭丄傔偭偒丄揹巕嶻嬈乮僐僱僋僞丄揹慄丄崅廃攇梡晹昳偺傔偭偒側偳乯丄幨恀弍丄嬀丄嬧嵶岺丄嬧儘僂丄帟壢梡丄側偳偝傑偞傑側暘栰偵媦傇丅
丂丂丒丂徤巁嬧偐傜嬧偺惗惉丗丂徤巁嬧悈梟塼偵扽巁僫僩儕僂儉傪壛偊傞偲丄扽巁僈僗傪敪惗偟偰扽巁嬧乮俙倗2俠俷3乯偑捑揳偡傞丅偙傟偼晄埨掕偱丄岝偵摉偨傞偲昞柺偑暘夝偟偰崟偭傐偔側傞丅扽巁嬧傪壛擬偡傞偲 俁侽侽亅係侽侽亷偱暘夝偟偰丄崟怓偺巁壔嬧傪宱偰丄嬧偵曄傢傞丅乮 拲乯 徤巁嬧偼旂晢傗堖椶側偳偺桳婡暔偲斀墳偟偰崟偔側傞偺偱寛偟偰晅偗側偄偙偲乯丂傑偨丄嬧傪嬻婥拞偱梟梈偡傞偲偒丄梈揰晅嬤偱巁慺傪嬧偺懱愊偺栺俀侽攞傕媧廂偟 嬅屌帪曻弌偡傞偺偱丄昞柺偑偁偽偨偵側傞丅嬧揰乮亖嬧偺梈揰乯應掕偺嵺傕梟懚巁慺偵傛偭偰戝暆偵嫸偆偺偱拲堄偑昁梫丅
丂丂丂丂丂丂丂丂丂丂丂俙倗2俠俷3丂仺丂俙倗2俷丂亄丂俠俷2仾丂丄丂丂丂丂丂俀俙倗2俷丂仺丂係俙倗丂亄丂俷2仾 乮俀俉侽亷暘夝乯

丂丂丂丂丂丂丂仸丂嬧庽丄嬧嬀偺幚尡偵偮偄偰丗丂仺丂乭嬧偺幚尡乭嶲徠
丂丂乮俀乯丂敀嬥偺幚尡丗
丂丂敀嬥懓尦慺偼丄媽丒戞嘯懓乮戞俉懓乯乮尰嵼偺俉丄俋丄侾侽懓乯偵埵抲偟丄揝懓尦慺乮俥倕丄俶倝丄俠倧乯偺偝傜偵戝偒側廃婜偵埵抲偟丄嬧傗嬥偲傕椬傝崌傢偣偱偁傞丅俆丄俇廃婜偺奺俁偮慻尦慺偱丄儖僥僯僂儉乮俼倳乯丄儘僕僂儉乮俼倛乯丄僷儔僕僂儉乮俹倓乯丄僆僗儈僂儉乮俷倱乯丄僀儕僕僂儉乮俬倰乯丄敀嬥乮俹倲乯偺俇尦慺偑敀嬥懓尦慺偲屇偽傟丄儔儞僞僲僀僪廂弅偵傛偭偰傎傏摨偠尨巕敿宎偺尦慺孮偱偁傞丅乮斾廳偼堎側傞乯 嶻弌偼崌嬥偱偺宍偑懡偔丄旕忢偵曃偭偰偄傞丅
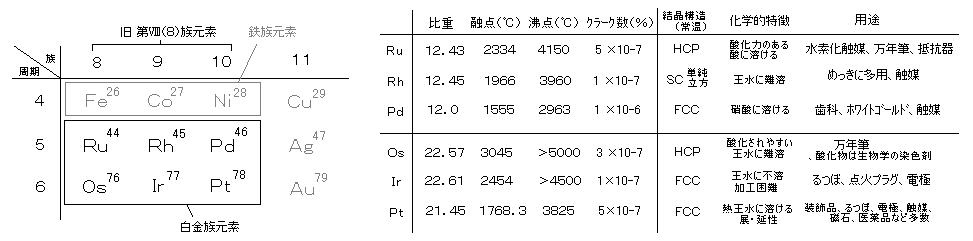
丂丂敀嬥乮俹倲乯偼丄梈揰乮侾俈俇俉亷乯偑崅偔丄壔妛揑偵埨掕偱巁丒傾儖僇儕偵傕懴偊丄壛岺傕偟傗偡偄偺偱丄壔妛幚尡傗壔妛岺嬈偺憰抲側偳偵傛偔梡偄傜傟偰偄傞丅乮偨偩偟丄崅壏偱扽慺傪媧廂偟掅壏偱曻弌偡傞偺偱惼偔側傞丅僈儔僗傗巁壔暔扨寢徎嵽椏側偳偼梟夝偱偒傞偑丄傾儖僇儕梟梈偱偼怤怘偝傟傞丅乯丂傑偨僜乕僟僈儔僗偲偺擬朿挘棪偑嬤偄偺偱丄僈儔僗晻擖偑梕堈偱偁傞丅偨偩偟丄擬偟偨墹悈乮擹墫巁丗擹徤巁亖俁丗侾乯偵偼梟偗丄墫壔敀嬥巁乮僿僉僒僋儘儘敀嬥巁丄俫2俹倲俠倢6乯偲側傞丅偙傟偼敀嬥壔崌暔傗怗攠惢憿丄傔偭偒側偳偺弌敪暔幙偲側傞丅丂敀嬥偺梡搑偼偝傑偞傑側暘栰偵媦傃丄曮忺昳偺傎偐偵丄傔偭偒丄壔妛梡丒帺摦幵梡偺怗攠丄壔妛梡偺傞偮傏丒梕婍丄揹嬌丄擬揹懳丄揰壩僾儔僌丄擱椏揹抮丄枩擭昅偺儁儞愭丄帴愇丄堛栻昳側偳旕忢偵懡婒偵傢偨傞丅
丂丂嘆丂敀嬥慄偺墹悈傊偺梟夝丗丂桳撆僈僗敪惗丒晠怘拲堄両丂丒丂擬揹懳梡敀嬥慄乮冇侽丏俆乯悢倗傪擬墹悈偵梟夝偟偰丄墫壔敀嬥巁乮僿僉僒僋儘儘敀嬥巁丄俫2俹倲俠倢6丒俇俫2俷丄挭夝惈乯傪嶌惢偡傞丅 姰慡偵梟偐偟偨屻傕丄俀亅俁夞忲敪姡屌偲擹墫巁傪壛偊傞偙偲傪孞傝曉偟偰丄墫壔僯僩儘僔儖乮俶俷俠倢乯傪捛偄弌偡丅嵟屻偺忲敪姡屌偼忲敪嶮偱悈暘傪彮偟巆偡傛偆偵偟偰拲堄怺偔峴偆丅乮寢徎壔偺偲偒墫壔悈慺偑堦婥偵曻弌偡傞偺偱拲堄丅仏 墫壔悈慺偼廃傝偺嬥懏側偳傪旕忢偵嶬傃偝偣傞偺偱丄屗奜丄僪儔僼僩側偳偺攔婥偑傛偔峴偒撏偄偨娐嫬偱峴側偆偙偲両乯丂戙昞揑側斀墳偼丄
丂丂丂丂丂丂丂丂丂丂丂丂俁 俹倲丂亄丂係 俫俶俷3丂亄丂侾俉 俫俠倢丂仺丂俁 俫2俹倲俠倢6丂亄丂係 俶俷 亄丂俉 俫2俷
丂丂丒丂墫壔敀嬥巁偼丄僫僩儕僂儉墫偼悈梟惈側偺偵懳偟丄僇儕僂儉墫丄儖價僕僂儉墫丄僙僔僂儉墫偼擄梟惈側偺偱丄掕惈暘愅偱僫僩儕僂儉偲暘棧偡傞偺偵梡偄傜傟傞丅乮俲2俹倲俠倢6丄墿怓捑揳乯丂傑偨丄墫壔敀嬥巁傪壛擬偡傞偲敀嬥偵暘夝偡傞偺偱丄擹梟塼傪僙儔儈僢僋僂乕儖側偳偵偟傒崬傑偣偰從偔偲丄巁壔怗攠偲偟偰桳岠側乭敀嬥愇柸乭偵側傞丅傑偨丄傾儞儌僯傾悈偲垷徤巁僫僩儕僂儉偲嶌梡偝偣傞偲丄僕傾儈僲垷徤巁敀嬥乮俹倲乮俶俫3乯2丒乮俶俷2乯2乯偑惗惉偟偰捑揳偡傞丅偙傟傕從偔偲梕堈偵敀嬥偵曄傢傞丅

丂丂丒丂擬揹懳梡偺敀嬥亅儘僕僂儉崌嬥慄乮俼倛侾俁亾乯偐傜丄儘僕僂儉傪暘棧偡傞丅墹悈偵偼弮敀嬥傛傝傕偼傞偐偵梟偗偵偔偄偑丄壗夞傕墹悈偲壛擬偟偰梟偐偟愗傞丅俵倗偱僙儊儞僥乕僔儑儞偟偰俹倲丄俼倛偺崿崌暡傪摼丄嵞搙墹悈偲擬偟偰 梟偗傗偡偄敀嬥傪彍嫀偡傞偲丄儘僕僂儉暡枛偺巆熢偑偱偒傞丅丂偙傟傪帪娫傪偐偗偰擬墹悈偵梟夝偝偣墫壔儘僕僂儉乮俼倛俠倢3丄愒儚僀儞怓乯梟塼偲偟丄悈巁壔僇儕僂儉梟塼偱拞榓偟偰 悈巁壔儘僕僂儉乮俼倛乮俷俫乯3丄墿妼怓乯傪捑揳偝偣傞丅丂偙偺悈巁壔儘僕僂儉偼婓墫巁傗婓棸巁偵梕堈偵梟偗丄儘僕僂儉壔崌暔傗儘僕僂儉傔偭偒偺弌敪尨椏偲側傞丅
丂丂嘇丂敀嬥傔偭偒偺幚尡丗丂姺婥拲堄両丂僕傾儈僲垷徤巁敀嬥乮僕僯僩儘僕傾儈儞敀嬥丄俹倲乮俶俫3乯2丒乮俶俷2乯2丄敀嬥暘丗俇侽丏俈亾丄墿敀怓偺寉偄恓忬寢徎丄悈偵擄梟丒丒丒丂嘆偺墫壔敀嬥巁偐傜庤惢乯俹倲 偲偟偰侾侽倗/倢丄徤巁傾儞儌僯僂儉 侾侽侽倗/倢丄垷徤巁僫僩儕僂儉 侾侽倗/倢丄傾儞儌僯傾悈乮俀俉亾乯 俆俆倣倢/倢 傪丄梺壏搙俋侽乣俋俀亷丄揹棳枾搙 侾俙/乮倓倣乯2乮偙偺偲偒 揹棳岠棪 侾侽乣俀侽亾丄傔偭偒懍搙 侾兪倣/侾侽暘乯偱丄晄梟惈梲嬌乮敀嬥斅丄敀嬥傔偭偒僠僞儞斅丄僀儕僕僂儉傔偭偒僠僞儞斅側偳乯偱傔偭偒偡傞丅揹夝拞偺潣漚偼廫暘峴側偆曽偑朷傑偟偄丅
丂丂丒丂幚尡偱偼丄旐傔偭偒暔偵冇侾侽倣倣僠僞儞朹傪梡偄偨偺偱丄俀侽侽們們僩乕儖價乕僇乕偵擖傟偰丄怹捫挿 俆丏俆們倣乮揹嬌娫嫍棧俀丏俆們倣乯丄柺愊俽 侽丏俀乮倓倣乯2丄亪揹棳 俬 亖 俀侽侽倣俙乮偨偩偟墌拰宍側偺偱庒姳壓偘傞乯丄 俹倲乮俶俫3乯2丒乮俶俷2乯2丗 俀丏俆倗丄俶俫4俶俷3丗 侾俆倗丄俶倎俶俷2丗 侾丏俆倗丄俶俫3乮俀俉亾乯丗 栺俉倣倢 傪 扙僀僆儞悈偵梟偐偟偰侾俆侽倣倢偲偟乮俋侽亷嬤偔偵壛擬偡傞偲梟偗傞乯丄庤帩偪偺僀儕僕僂儉傔偭偒僠僞儞儊僢僔儏傪晄梟惈梲嬌偲偟偰敀嬥傔偭偒傪峴側偭偨丅揹夝揹埑偼侾丏俆倁掱搙偩偭偨丅
丂丂僠僞儞偵傔偭偒傪偡傞応崌丄俀乣俈兪倣偱暯妸偱岝戲偑椙偔丄岤偝侾侽兪倣傑偱偼僺儞儂乕儖傗僋儔僢僋偑敪惗偟側偄偲偝傟傞丅 偨偩偟丄俁侽侽們們價乕僇乕偱搾愾偟偨偲偙傠丄梺偺壏搙偼俉俋亷慜屻偱傗傗掅傔偩偭偨丅 梺偺忲敪偑偐側傝偁傞偺偱丄栺侾侽亾傾儞儌僯傾悈傪搑拞偱俀夞曗廩偟偰 栺侾帪娫揹夝偟偨丅傑偨丄棤懁偑晅偐側偄偺偱丄僠僞儞朹傪侾俉侽亱夞揮偝偣偰嵞搙梺傪挷惍偟偰傔偭偒偟偨丅
丂丂乮仏丂僕僯僩儘僕傾儈儞梺偼丄偙偺傾儞儌僯僂儉墫巊梡埲奜偵丄 僕僯僩儘僕傾儈儞敀嬥 侾俇丏俆倗/倢丄恷巁僫僩儕僂儉 俈侽倗/倢丄扽巁僫僩儕僂儉 侾侽侽倗/倢丄俉侽乣俋侽亷丄侽丏俆俙/乮倓倣乯2偱揹棳岠棪俁俆乣係侽亾丄傕梡偄傜傟偰偄傞丅乯

丂丂乮捛壛丂2021 6乯丂嘇乫丂僕傾儈僲垷徤巁敀嬥乮僕僯僩儘僕傾儈儞敀嬥丄俹倲乮俶俫3乯2丒乮俶俷2乯2丂偺嶌惉丗
丂丂傑偢丄墫壔敀嬥巁乮僿僉僒僋儘儘敀嬥巁丄俫2俹倲俠倢6丒俇俫2俷乯偲墫壔僇儕僂儉俲俠倢偺悈梟塼偐傜丄墫壔敀嬥巁僇儕僂儉俲2俹倲俠倢6傪捑揳偝偣丄傠夁丒愻忩丒姡憞偟偰嶌偭偰偍偔丅偙偺俲2俹倲俠倢6偺俋倗傪庢傝丄悈侾侽侽倣倢偵寽戺偝偣壛擬偟丄垷徤巁僫僩儕僂儉俶倎俶俷2偺屌懱暡枛侾俆倗傪彮偟偯偮壛偊丄悈傪懌偟側偑傜幭暒偟懕偗丄塼偑乮墿怓偐傜乯柍怓偵側傞傑偱俶俷2傪捛偄弌偡丅
丂丂偙偺俲2乮俹倲乮俶俷2乯4乯梟塼偵丄斀墳検偺俀俶俫俁傪壛偊乮俀俉亾俶俫3俀侽倣倢亄悈俉倣倢仺俀侽亾俶俫3丄丂偙偺俀侽亾俶俫3傪俁丏俀倣倢壛偊傞乯丄悈傪係亅俆攞壛偊偰幭暒偡傞偲偄偭偨傫梟偗丄曻椻偡傞偲懡偔偺恓忬寢徎偑捑揳偡傞丅丂偙傟傪傕偆堦搙擬悈偐傜嵞寢徎偡傞丅
丂

丂丂乮俁乯丂嬥偺幚尡丗
丂丂嬥乮俙倳丄尨巕斣崋 俈俋丄梈揰 侾侽俇係丏俀亷丄斾廳 侾俋丏俁侽丄揹婥堿惈搙乮芜柏莞迊j俀丏俆係丄僋儔乕僋悢 侽丏侽侽俆倫倫倣亖俆亊侾侽-7亾乯偼丄憂悽婰偺戝愄偐傜丄嶻弌検偑彮側偔壙抣偁傞傕偺偲偟偰丄壿暭偵憡摉偡傞傕偺丄嵳媀丄曮忺昳偲偟偰梡偄傜傟偰偒偨丅弮嬥偼揥惈丒墑惈偵晉傒丄幨恀偺侾侽們倣妏丒岤傒偑侽丏侽侽侽侾倣倣偺嬥敁偼丄侾倣倣棫曽偺嬥偵憡摉偡傞丅丂嬥偼壔妛揑偵偼旕忢偵埨掕偱丄傎偲傫偳偺巁丒傾儖僇儕偵梟偗偢丄嬻婥拞偱巁壔偣偢丄曄傢傜側偄婸偒傪掓偡傞偺偱丄儔僥儞岅偱偼俙倳倰倳倣乮岝傞傕偺乯偲屇偽傟丄嬥偺尦慺婰崋偼俙倳偱偁傞丅
丂丂偟偐偟丄嬥偼墹悈乮巊梡捈慜偵崿偤偨擹墫巁乮俁俇亾慜屻乯丗擹徤巁乮俇侾亾慜屻乯亖俁丗侾乯偵偼梟偗丄墫壔嬥巁 俫俙倳俠倢4 傪惗偠傞丅傑偨嬥偼丄墫慺悈丄廘慺悈丄擹墫巁偲夁巁壔悈慺悈偲偺崿崌塼丄儓乕僪僠儞僉側偳偺梀棧忬偺僴儘僎儞偲斀墳偟偰梟偗傞丅丂悈嬧偲偼傾儅儖僈儉傪惗偠偰梟偗傞丅
丂丂丂丂丂丂丂丂丂丂丂丂俙倳丂亄丂俫俶俷3丂亄丂係 俫俠倢丂仺丂俫俙倳俠倢4丂亄丂俶俷丂亄丂俀 俫2俷
丂丂嘆丂嬥偺梟夝丗丂丂弮嬥敁傪僈儔僗朹偵姫偒晅偗丄墫巁偲夁巁壔悈慺悈偲偺崿崌塼偵擖傟傞偲丄敪惗偟偨梀棧忬偺墫慺偵傛偭偰娙扨偵梟偗傞丅乮 拲乯 嬥敁偵彮偟偱傕嬧偑崿偠偭偰偄傞偲媫偵梟偗偵偔偔側傞乯丂儓乕僪僠儞僉乮儓僂慺亄儓僂壔僇儕僂儉偺悈梟塼乯偵偼備偭偔傝梟偗傞丅

丂丂嘇丂嵞惗嬥偺幚尡丗丂丂揹巕晹昳偺攑嵽偺傔偭偒偝傟偨嬥傪夞廂偟偰傒偨丅婎斅偺僾儔僗僠僢僋傪從偄偰偐傜丄摵傪擹徤巁偱梟偐偟嫀傝丄巆傝偺扽慺暘傪嫮擬偟偰擱從偝偣傞偲丄傞偮傏偺掙偵嬥暡乮亄奃暘丒俽倝俷2側偳乯偑巆傞丅
丂

丂丂乮嶲峫乯丂丂僈乕僫偵偍偗傞嬥杧傝丗
丂丂昅幰偺桭恖偑傾僼儕僇丒僈乕僫偱傗偭偰偄傞嬥嵦孈尰応丗乮僈乕僫偼嬥嵦孈検偑悽奅偱侾侽埵乯丂僈乕僫偱偼攋嵱愝旛偑昁梫側乭嶳嬥乭偱偼側偔丄業揤孈傝偵嬤偄乭愳嬥乭偑懡偄丅偨偩偟丄嬥柆偺嬥娷桳検偑暯嬒俁乣俈倗/倲倧値掱搙側偺偱丄晛捠偼 彫婯柾偺恖奀愴弍偱偼嵦嶼偑崌傢側偄丅嵦嶼偑庢傟傞偨傔偵偼丄偄偐偵戝検偺峼揇傪張棟偱偒傞偐偵偐偐偭偰偄傞丅偙偺僾儗僗僥傾抧曽偺幖抧懷偱丄戝婯柾曽幃偱岠棪傛偔嵦孈嶌嬈傪峴側傢側偗傟偽側傜偢丄偁傞掱搙偺搳帒偑昁梫偲側傞丅 嵟廔岺掱偱偼嬥傪乭婑偣傞乭偨傔偵悈嬧傪梡偄傞丅乮 拲乯 悈嬧忲婥傪媧偄崬傓偲岮偑偮傇傟傑偡乯